出口通关要求
1.商品归类:
除特殊情况外,常见防护手套、护目镜应归入下列税号:
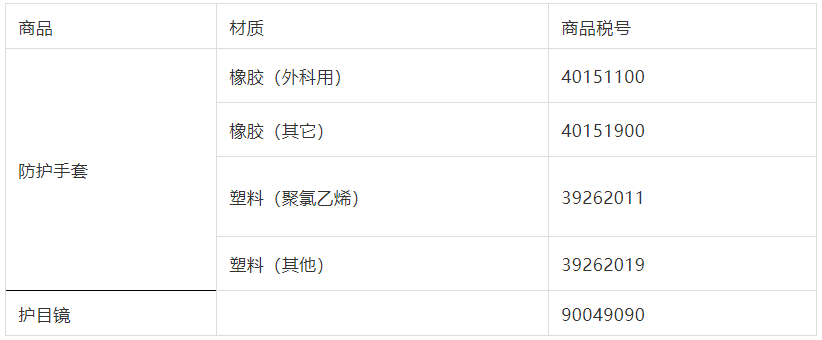
2.禁限管理:
目前商务部未对防护手套、护目镜设置贸易管制要求,中国海关也无针对手套、护目镜物资的监管证件口岸验核要求。
3.出口退税:
防护手套、护目镜的出口退税率为13%
疫情防控需要的防护手套、护目镜出口涉及的公司资质证明材料与出口口罩基本相同,可参见《口罩出口指南|看这里就对啦》
↓↓↓以下内容是根据国内外相关政府机构、↓↓↓
专业网站、新闻报道收集整理而成,
仅供参考。具体内容以相关管理部门、
国外官方机构最新要求为准。
防护手套分类:
防护手套按照材质不同可分为丁腈手套、PVC手套、乳胶手套和PE手套,根据品质等级和用途可分为医疗级和非医疗级,医疗级手套是指需要满足目标国家医疗市场质量认证体系或准入标准的产品,主要用于医疗手术、医疗检查、医疗护理等领域。

护目镜:
护目镜防止一些飞沫或血液等飞溅到脸部,因而对眼睛起保护作用,一般和口罩、手术帽配合使用,对头部起到全面防护作用。
各国防护手套、护目镜准入条件
产品准入条件:
美国:
必须要取得美国食品和药物管理局FDA注册认证才可以在美国本土市场进行销售。
防护手套:
一次性医用手套,包括用于处理化学治疗剂(化疗手套)的检查手套,手术手套和医用手套。这些手套由FDA监管为医疗器械,需要按照美国《联邦食品、药品和化妆品法》510(k)条款的要求执行上市前通告(Premarket Notification),向FDA申请产品上市许可。FDA审查这些设备,以确保满足诸如防漏性,抗撕裂性和生物相容性等性能标准。
提示注意:2016年12月19日,美国食品和药物管理局发布了一项禁止粉末手套的最终规则,决定在医疗活动中禁用有粉手套,包括有粉外科手套、检查手套和用于润滑可吸收粉末的外科手套
护目镜:
护目镜通常注册Ⅰ类医疗器械,绝大部分产品是510K豁免的,实行的是一般控制(General Control),企业只需要进行企业注册(Registration)和产品列名(Listing),和实施GMP规范QSR820(其中一部分产品连GMP也豁免),产品即可进入美国市场。
欧盟:
须获得欧盟CE认证,并符合技术法规:(EU)2016/425
手套、护目镜与防护服同属个人防护装备(PPE),在欧盟同受(EU)2016/425技术法规管辖,需要强调的是欧盟法规(EU) 2016/425,于2018年4月21日正式实施,撤销并替代了PPE指令89/686/EEC,并指出2019年4月21日之后投放市场的产品必须满足(EU)2016/425中所有的要求,此期限,出口外贸企业和生产企业须重点注意。
欧盟个人防护装备法规(EU)2016/425协调标准查询:https://ec.europa.eu/growth/single-market/european-standards/harmonised-standards/personal-protective-equipment_en
日本:
如果需要投放市场产品必须满足日本的Pharmaceutical and Medical Device Act (PMD Act),在PMD Act的要求下,TOROKU注册系统要求国外的制造商必须向PMDA注册制造商信息。
日本医药品和医疗器械综合机构(PMDA)网址:www.pmda.go.jp
韩国:
韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association. 提前备案进口资质(没有不行)网址:www.kpta.or.kr
澳大利亚:
须通过澳洲的TGA注册,TGA 是Therapeutic Goods Administration的简写,全称是治疗商品管理局。澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,分别为豁免、备案和注册。无论哪类医疗器械,其上市销售前必须得到澳大利亚政府的准许,符合医疗器械的基本要求,按照符合性审查程序进行审查。
医用手套、护目镜一般归为中低风险和低风险的医疗器械,对于低风险的医疗器械由企业自行进行评估,只要符合质量和安全条件即可进入市场,但要提供相关文件证明其安全有效,并进入医疗用品注册系统,进行编号管理。大多数的器械按备案方式进行管理,通过简要评估检查是否符合生产、标签以及质量标准。
特别提醒:澳大利亚已与欧盟达成互认协议。这意味着,合格评定证书由TGA颁发的也被欧盟认可,TGA也认可欧盟CE认证。已获CE认证的用户,可提交CE证书及相关资料,获得TGA证书。
如果产品已经注册或备案,制造商更换经销商对其没有影响。对国外产品进行注册审批后,每年还要常规注册一次,说明产品型号、性能及质量有无变化。TGA 全权负责对医疗器械的符合性评价,并收取一定费用,相关费用金额可参见 TGA的网站
出口日本、韩国、澳大利亚的防护手套、护目镜注册、认证流程与医用口罩相同,具体流程可参见《口罩出口指南|看这里就对啦》
一次性使用医用手套
国内外标准及指标比对
(供生产企业参考)
一次性使用医用橡胶检查手套国内外标准比对
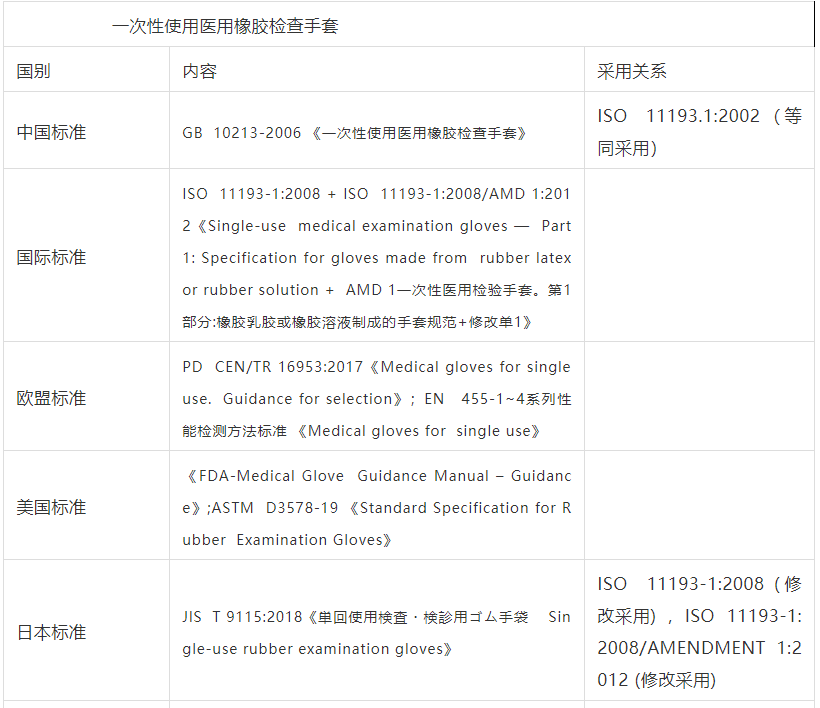

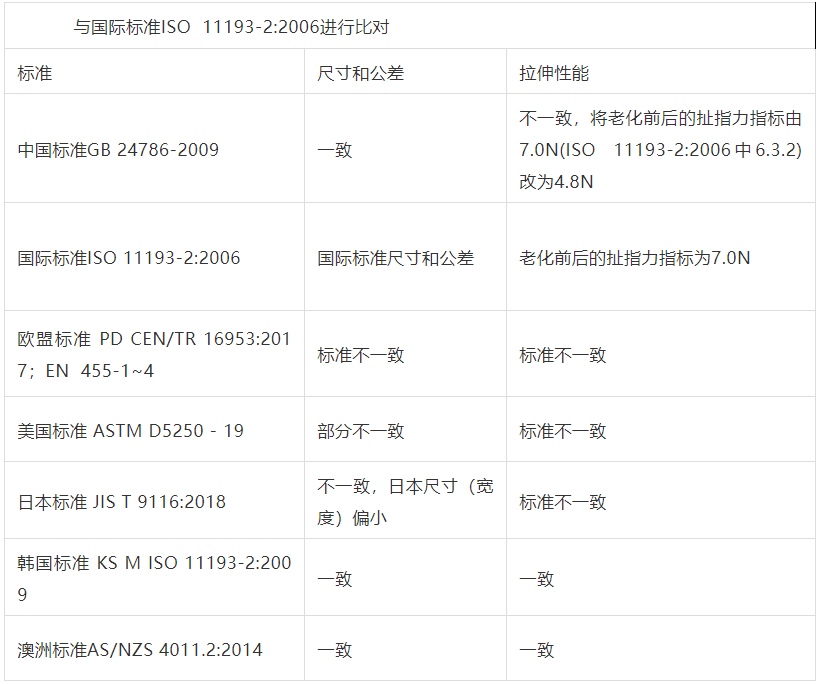
一次性使用医用橡胶检查手套指标比对

一次性使用医用聚氯乙烯检查手套国内外标准比对

一次性使用医用聚氯乙烯检查手套指标比对
一次性使用外科手套国内外标准比对
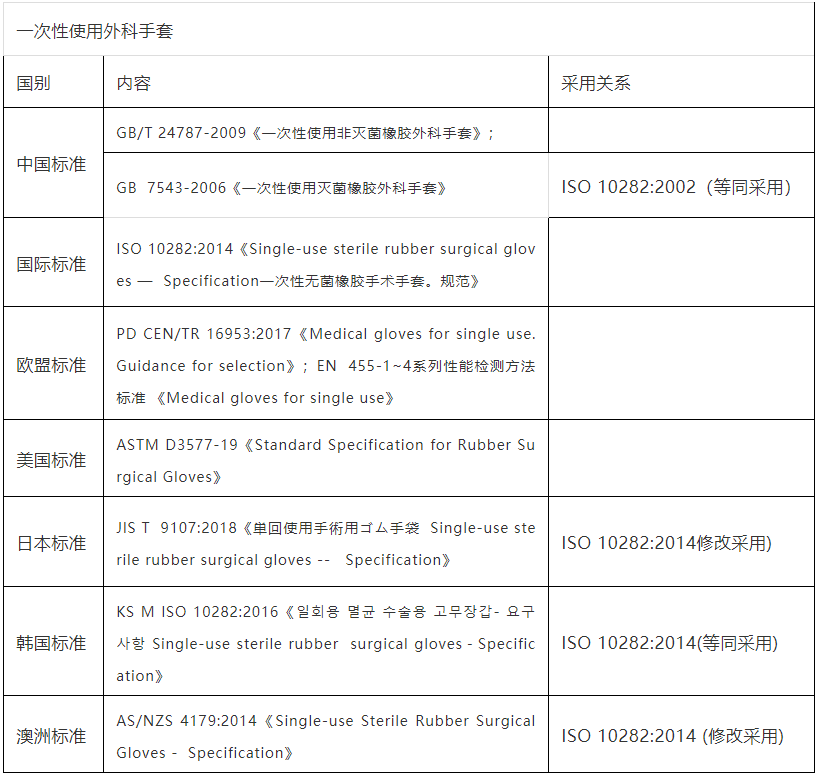
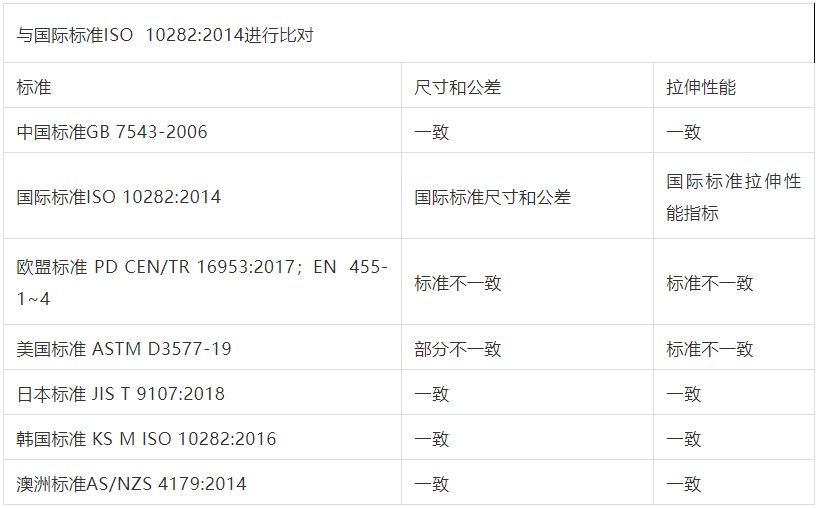
一次性使用外科手套指标比对
护目镜
国内外标准及指标比对
我国护目产品生产主要采用强制性国家标准 GB 14866-2006《个人用眼护具技术要求》。该标准规定了个人用眼护具的光学、抗冲击、耐热、耐腐蚀、刺激性气体 防护等技术性能要求及相应的试验方法,适用于除核辐射、X 光、激光、紫外线、红 外线及其他辐射以外的各类个人用眼护具。
根据护具的外形可以分为眼镜、眼罩和 面罩,镜片分为有机镜片和无机镜片两种。
眼部护具应具备提供保护及对抗:
1)不同强度的冲击、2)可见光辐射、3)熔融金属飞溅、4)液体雾滴和飞溅、5)粉尘、6) 刺激性气体等伤害或这些类型伤害的人和组合的功能。
美国 NFPA 1999 中规定,如果一次性护目产品覆盖眼睛部分不是一整块塑料或固体薄膜,用于护目产品的材料应进行微生物透过测试。
除此之外还要进行液体完整性测试、视力成雾性试验。如护目产品中有使用织物,则每一层织物还要进行可燃性试验,火焰蔓延时间应在 3.5 秒以上。
美国标准 ANSI Z87.1-2015《职业和教学用个人眼部和面部防护装备》适用于焊 接用防护目镜、护目镜、面罩等产品,规定了眼部防护装备的光学要求、物理性能、镜片最小厚度、耐冲击性能以及对光辐射、液体雾滴和飞溅、粉尘等的防护要求。
各国护目镜技术标准
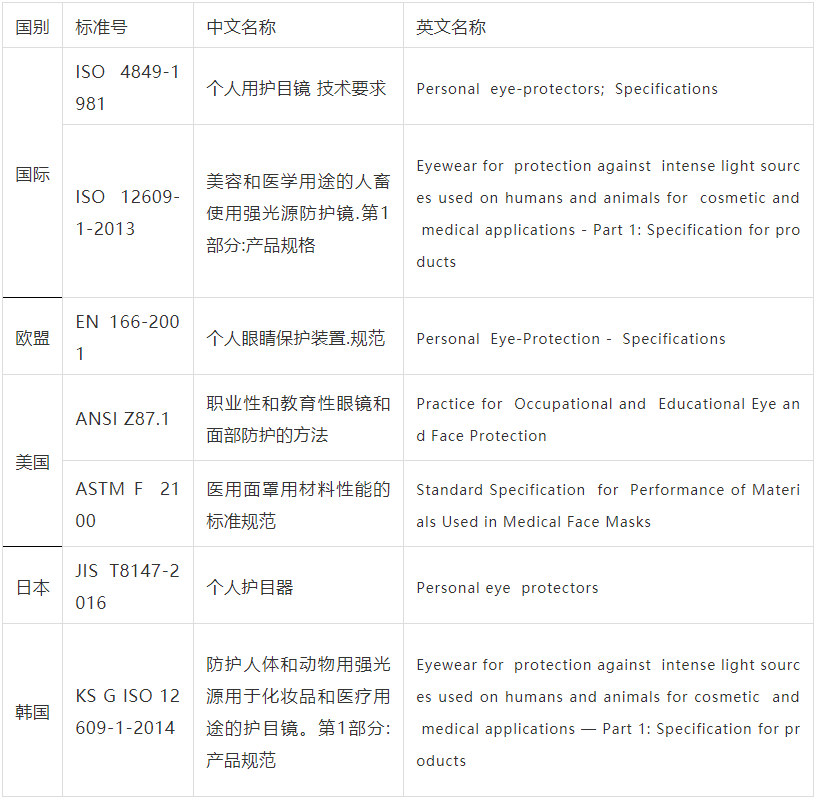
(本文所列准入条件、技术标准等为国内外政府机构、专业网站、新闻报道收集整理而成)
了解更多防护类产品出口相关详细,可以直接咨询我们的技术人员以帮助确认产品的最新测试要求。
————END————
 English
English