近日,许多客户咨询我们口罩出口相关问题,现在伍祥就整理了客户最关心的口罩出口五大问题,来为有需要的厂商解答。

2020年3月31日,商务部与海关总署、药监局联合发布了2020年第5号公告,提出了最新医疗物资出口质量监管措施。
01/ Q:新措施发布后,对于不同类型的口罩,如何定位更便于出口呢?
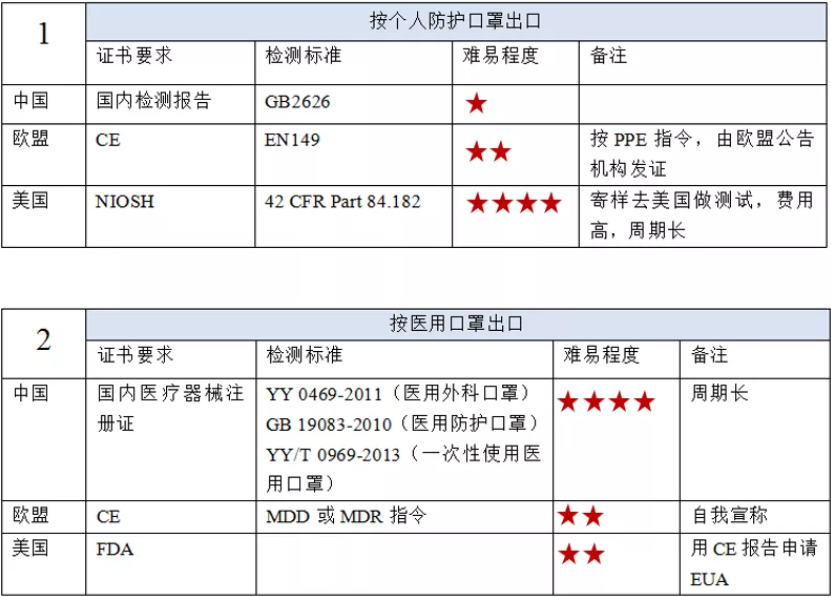
1、N95口罩|要求及测试标准

2、平面口罩|要求及测试标准
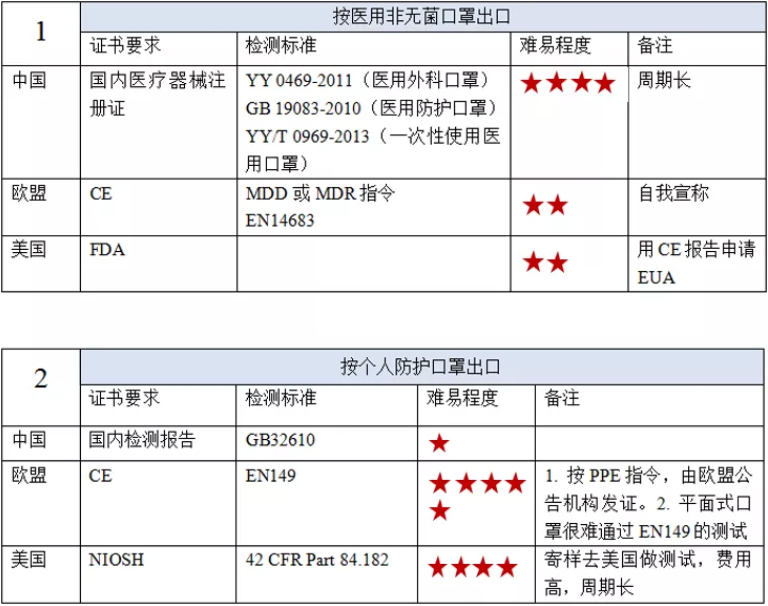

02/ Q:平面口罩申请医疗注册证,需要的周期要多久?
因为已取消了应急通道,目前医疗注册证的办理时间较长,预计需要4-5个月。
加急处理,企业技术文件一次性符合审查要求的情况下,能加快至3个月。

03/ Q:目前法国认可了国标测试报告,是否还需找公告机构发证?
由于疫情原因为保障防护用品的充足供应,近日法国海关与间接税总署官方网站发布信息:个人防护用品只要符合欧洲标准或相关等效标准,便可在无CE标识的情况下进入法国市场。
法国海关公布的外国等效标准清单中包括4项中国口罩标准:
GB 19083-2010《医用防护口罩技术要求》、
GB2626-2006《呼吸防护用品—自吸过滤式防颗粒物呼吸器》、
YY/T 0969-2013《一次性使用医用口罩》、
YY 0469-2011《医用外科口罩》.
经与法国公告机构确认,他们在收到PPE认证申请和测试样品后,如客户可以提供上述标准的国标报告,可以发行一份证明函,允许出货【仅限法国海关】。
更多详细信息可在法国海关与间接税总署网站查询。

04/ Q:出口到美国的N95口罩做NIOSH认证,需准备哪些资料?
1 认证申请方式:NIOHS认证,只能由制造商申请(伍祥可提供辅导服务)。
2 周期:周期时长预计需要半年;Q:能否加急?A:疫情形势下,美国NIOSH实验室检测量陡增,周期无法缩短。
3 建议提前做NIOSH预测试报告

05/ Q:NIOSH预测试报告有什么作用?
该报告可用于之后申请NIOSH认证时的参考依据。在官方审核时,起到加速的作用外,也有助于增加通过最终测试的几率。对于EUA不停变化的情况下,持有一份美国报告还是很有好处的。
了解更多口罩出口相关详细,可以直接咨询我们的技术人员以帮助确认最新测试要求。
 English
English